Dušična kiselina
| Dušična kiselina HNO3 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||
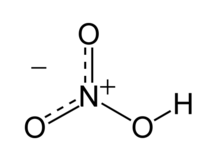 | ||||||||||||||
| IUPAC nomenklatura | Dušična kiseline | |||||||||||||
| Ostala imena | Nitritna kiselina | |||||||||||||
| Identifikacijski brojevi | ||||||||||||||
| CAS broj | 12507-77-6 7697-37-2, 12507-77-6 ✓ | |||||||||||||
| UN broj | 2031 ✓ | |||||||||||||
| RTECS broj | QU5775000 ✓ | |||||||||||||
| EC broj | 231-714-2 ✓ | |||||||||||||
| PubChem broj | 944 ✓ | |||||||||||||
| Osnovna svojstva | ||||||||||||||
| Molarna masa | 63,012 g·mol−1 | |||||||||||||
| Izgled | bistra, bezbojna tekućina | |||||||||||||
| Gustoća |
1,5129 g/L, plin | |||||||||||||
| Talište | 231 K -42°C | |||||||||||||
| Vrelište | 356 K 83°C | |||||||||||||
| Dipolni moment |
2.17 ± 0.02 D | |||||||||||||
| Struktura | ||||||||||||||
| Sigurnosne upute | ||||||||||||||
| ||||||||||||||
| Međunarodni sustav mjernih jedinica primijenjen je gdje god je to bilo moguće. Ako nije drugačije naznačeno, upisane vrijednosti izmjerene su pri standardnim uvjetima. | ||||||||||||||
| Portal:Kemija | ||||||||||||||
Dušična kiselina je anorganski spoj formule HNO3. To je vrlo korozivna mineralna kiselina.[1] Spoj je bezbojan, ali uzorci s vremenom poprimaju žutu nijansu zbog razgradnje na dušikove okside. Većina komercijalno dostupne dušične kiseline ima koncentraciju od 68% u vodi. Kada otopina sadrži više od 86% HNO3, naziva se dimeća dušična kiselina. Ovisno o količini prisutnog dušikovog dioksida, dimeća dušična kiselina dalje se karakterizira kao crvena dimeća dušična kiselina pri koncentracijama iznad 86%, ili bijela dimeća dušična kiselina pri koncentracijama iznad 95%.
Dušična kiselina primarni je reagens koji se koristi za nitriranje – dodavanje nitro skupine, obično organskoj molekuli. Dok su neki nastali nitro spojevi eksplozivi osjetljivi na udare i toplinu, neki su dovoljno stabilni da se koriste u municiji i za uništavanje, dok su drugi još stabilniji i koriste se kao sintetičke boje i lijekovi (npr. metronidazol). Dušična kiselina također se često koristi kao jako oksidacijsko sredstvo.
Povijest
urediSrednjovjekovna alkemija
urediOpćenito se vjeruje da otkriće mineralnih kiselina poput dušične kiseline potječe iz europske alkemije iz 13. stoljeća.[2] Konvencionalno gledište je da je dušična kiselina prvi put opisana u pseudo-Geberovom djelu De inventione veritatis ("O otkriću istine", nakon c. 1300).[3]
Međutim, prema Ericu Johnu Holmyardu i Ahmadu Y. al-Hassanu, dušična kiselina također se pojavljuje u raznim ranijim arapskim djelima kao što je Ṣundūq al-ḥikma ("Škrinja mudrosti") koja se pripisuje Jabiru ibn Hayyanu (8. stoljeće) ili Taʿwīdh al-Ḥākim pripisuje se fatimidskom halifi al-Hakimu bi-Amr Allah (985–1021).[4]
Recept u Ṣundūq al-ḥikma koji se pripisuje Jabiru preveden je na sljedeći način:[5][6]
Uzmite pet dijelova čistog cvijeća nitra, tri dijela ciparskog vitriola i dva dijela jemenske stipse. U prahu ih dobro, odvojeno, dok ne postanu poput prašine, a zatim ih stavite u tikvicu. Potonji začepite palminim vlaknom i na njega pričvrstite stakleni prijemnik. Zatim okrenite aparat i zagrijte gornji dio (tj. tikvicu koja sadrži smjesu) na laganoj vatri. Zbog topline će teći ulje poput kravljeg maslaca.
Dušična kiselina također se nalazi u djelima nakon 1300. koja se lažno pripisuju Albertu Velikom i Ramonu Llullu (obojica iz 13. stoljeća). Ovi radovi opisuju destilaciju smjese koja sadrži niter i zeleni vitriol, koju nazivaju "eau forte" (aqua fortis).[7][8][9]
Moderno doba
urediU 17. stoljeću Johann Rudolf Glauber osmislio je postupak za dobivanje dušične kiseline destilacijom kalijevog nitrata sa sumpornom kiselinom. Godine 1776. Antoine Lavoisier citirao je rad Josepha Priestleya kako bi istaknuo da se može pretvoriti iz dušikovog oksida (koji on naziva "dušikovim zrakom"), "pomiješanog s približno jednakim volumenom najčišćeg dijela običnog zraka, i sa značajnom količinom voda."[10] Godine 1785. Henry Cavendish odredio je njen točan sastav i pokazao da se može sintetiziran propuštanjem struje električnih iskri kroz vlažan zrak.[7] Godine 1806. Humphry Davy izvijestio je o rezultatima opsežnih eksperimenata elektrolize destilirane vode zaključivši da je dušična kiselina proizvedena na anodi iz otopljenog atmosferskog dušika. Koristio je visokonaponsku bateriju i nereaktivne elektrode i posude poput stožaca zlatnih elektroda koje su služile kao posude premoštene vlažnim azbestom.[11]
Industrijska proizvodnja dušične kiseline iz atmosferskog zraka započela je 1905. Birkeland-Eydeovim procesom, također poznatim kao lučni proces.[12] Ovaj se proces temelji na oksidaciji atmosferskog dušika atmosferskim kisikom u dušikov oksid s električnim lukom vrlo visoke temperature. Prinosi do približno 4-5% dušikovog oksida dobiveni su na 3000 °C, a manji na nižim temperaturama.[13][14] Dušikov oksid je ohlađen i oksidiran pomoću preostalog atmosferskog kisika u dušikov dioksid, a ovaj je zatim apsorbiran u vodi u nizu apsorpcijskih tornjeva napunjenih kolona ili pločastih kolona kako bi se proizvela razrijeđena dušična kiselina. Prvi tornjevi propuštali su dušikov dioksid kroz vodu i nereaktivne krhotine kvarca. Oko 20% proizvedenih dušikovih oksida ostalo je neizreagirano pa su konačni tornjevi sadržavali alkalnu otopinu za neutralizaciju ostatka.[15] Proces je bio vrlo energetski intenzivan i brzo ga je istisnuo Ostwaldov proces kada je postao dostupan jeftini amonijak.
Drugu ranu proizvodnu metodu izumio je francuski inženjer Albert Nodon oko 1913. Njegovom metodom proizvedena je dušična kiselina elektrolizom kalcijevog nitrata kojeg su bakterije pretvorile iz dušične tvari u tresetnim močvarama. Lonac od zemljane posude okružen vapnencem uronjen je u treset i obložen katranom da bi se napravio odjeljak za ugljičnu anodu oko koje se stvara dušična kiselina. Dušična kiselina ispumpana je iz zemljane[16] cijevi koja je bila potopljena na dno lonca. Svježa voda je pumpana u vrh kroz drugu zemljanu cijev kako bi se zamijenila uklonjena tekućina. Unutrašnjost je bila ispunjena kokakolom. Katode od lijevanog željeza potopljene su u treset koji ga okružuje. Otpor je bio oko 3 ohma po kubnom metru, a dovedena snaga je bila oko 10 volti. Proizvodnja iz jednog ležišta bila je 800 tona godišnje.[16][17]
Nakon što je 1913. uveden Haber - Boschov postupak za učinkovitu proizvodnju amonijaka, proizvodnja dušične kiseline iz amonijaka pomoću Ostwaldovog procesa prestigla je proizvodnju iz Birkeland-Eydeovog procesa. Ovaj način proizvodnje je u upotrebi i danas.
Fizikalna i kemijska svojstva
urediKomercijalno dostupna dušična kiselina je azeotrop s vodom u koncentraciji od 68% HNO3. Ova otopina ima temperaturu vrenja od 120,5 °C (249 °F) pri 1 atm. Poznata je kao "koncentrirana dušična kiselina". Azeotrop dušične kiseline i vode je bezbojna tekućina na sobnoj temperaturi.
Poznata su dva čvrsta hidrata: monohidrat HNO3·H2O ili oksonijev nitrat [H3O]+[NO3]− i trihidrat HNO3·3H2O.
Povremeno se može vidjeti starija ljestvica gustoće, s koncentriranom dušičnom kiselinom označenom kao 42 Baumé.[18]
Kontaminacija sa dušikovim dioksidom
urediDušična kiselina je podložna toplinskom ili svjetlosnom raspadu i zbog toga se često čuvala u smeđim staklenim bocama:
4 HNO3 → 2 H2O + 4 NO2 + O2
Ova reakcija može dovesti do nekih nezanemarivih varijacija u tlaku pare iznad tekućine jer se proizvedeni dušikovi oksidi djelomično ili potpuno otope u kiselini.
Dušikov dioksid (NO2) i/ili didušikov tetroksid (N2O4) ostaje otopljen u dušičnoj kiselini bojeći je žuto ili čak crveno na višim temperaturama. Dok čista kiselina ispušta bijele pare kada je izložena zraku, kiselina s otopljenim dušikovim dioksidom ispušta crvenkasto-smeđe pare, što dovodi do uobičajenih naziva "crvena dimeća dušična kiselina" i "bijela dimeća dušična kiselina". Dušikovi oksidi (NOx) topljivi su u dušičnoj kiselini.
Dimeća dušićna kiselina
urediKomercijalna dimeća dušična kiselina sadrži 98% HNO3 i ima gustoću od 1,50 g/cm3. Ovaj stupanj se često koristi u industriji eksploziva. Nije tako hlapljiva niti tako korozivna kao bezvodna kiselina i ima približnu koncentraciju od 21,4 M.
Crvena dimeća dušična kiselina ili RFNA sadrži značajne količine otopljenog dušikovog dioksida (NO2) zbog čega otopina ima crvenkasto-smeđu boju. Zbog otopljenog dušikovog dioksida, gustoća crvene dimeće dušične kiseline je niža i iznosi 1,490 g/cm3.
Inhibirana dimeća dušična kiselina, bilo bijela inhibirana dimeća dušična kiselina (IWFNA), ili crvena inhibirana dimeća dušična kiselina (IRFNA), može se dobiti dodavanjem 0,6 do 0,7% fluorovodika (HF). Ovaj fluorid se dodaje radi otpornosti na koroziju u metalnim spremnicima. Fluor stvara sloj metalnog fluorida koji štiti metal.
Bezvodna dušična kiselina
urediBijela dimeća dušična kiselina, čista dušična kiselina ili WFNA, vrlo je bliska bezvodnoj dušičnoj kiselini. Testom je dostupan kao 99,9% dušična kiselina ili oko 24 molarna. Jedna specifikacija za bijelu dimeću dušičnu kiselinu je da ima najviše 2% vode i najviše 0,5% otopljenog NO2. Bezvodna dušična kiselina bezbojna je (mobilna) tekućina niske viskoznosti gustoće 1,512–3 g/cm3 koja se skrućuje na –42 °C (–44°F) i stvara bijele kristale. Njena dinamička viskoznost ispod standardnim uvjetima je 0,76 cP.[19] Kako se razlaže na NO2 i vodu, dobiva žutu nijansu. Vrije na 83 °C (181 °F). Obično se skladišti u staklenoj boci boje jantara otpornoj na lomljenje s dvostruko većim volumenom prostora kako bi se omogućio porast tlaka, ali čak i uz te mjere opreza, bocu je potrebno prozračivati svaki mjesec kako bi se oslobodio tlak.
Struktura i vezivanje
urediDvije terminalne N-O veze su gotovo jednake i relativno kratke, na 1,20 i 1,21 Å.[20] To se može objasniti teorijama rezonancije; dva glavna kanonska oblika pokazuju neki karakter dvostruke veze u ove dvije veze, uzrokujući da budu kraće od N–O jednostrukih veza. Treća N–O veza je produžena jer je njen O atom vezan za H atom,[21][22] s duljinom veze od 1,41 Å u plinovitoj fazi.[20] Molekula je blago aplanarna (ravnine NO2 i NOH nagnute su jedna od druge za 2°) i postoji ograničena rotacija oko jednostruke veze N–OH.[6][23]
Reakcije
urediKiselo - bazna svojstva
urediDušična kiselina se obično smatra jakom kiselinom na sobnoj temperaturi. Postoje određena neslaganja oko vrijednosti konstante disocijacije kiseline, iako se vrijednost pKa obično navodi kao manja od -1. To znači da je dušična kiselina u razrijeđenoj otopini potpuno disocirana osim u izrazito kiselim otopinama. Vrijednost pKa raste do 1 na temperaturi od 250 °C.[24]
Dušična kiselina može djelovati kao baza u odnosu na kiselinu kao što je sumporna kiselina:
HNO3 + 2 H2SO4 ⇌ [NO2]+ + [H3O]+ + 2 HSO4- Konstanta ravnoteže: K ≈ 22
Nitronijev ion, [NO2]+, aktivni je reagens u reakcijama nitriranja aromatskih spojeva. Budući da dušična kiselina ima i kisela i bazična svojstva, može proći kroz reakciju autoprotolize, sličnu samoionizaciji vode:
2 HNO3 ⇌ [NO2]+ + NO3- + H2O
Reakcije s metalima
urediDušična kiselina reagira s većinom metala, ali detalji ovise o koncentraciji kiseline i prirodi metala. Razrijeđena dušična kiselina ponaša se kao tipična kiselina u reakciji s većinom metala. Magnezij, mangan i cink oslobađaju H2:
Mg + 2 HNO3 → Mg(NO3)2 + H2
Mn + 2 HNO3 → Mn(NO3)2 + H2
Zn + 2 HNO3 → Zn(NO3)2 + H2
Dušična kiselina može oksidirati neaktivne metale kao što su bakar i srebro. Kod ovih neaktivnih ili manje elektropozitivnih metala proizvodi ovise o temperaturi i koncentraciji kiseline. Na primjer, bakar reagira s razrijeđenom dušičnom kiselinom na sobnoj temperaturi sa stehiometrijom 3:8:
3 Cu + 8 HNO3 → 3 Cu(NO3)2 + 2 NO + 4 H2O
Proizvedeni dušikov oksid može reagirati s atmosferskim kisikom i dati dušikov dioksid. S više koncentrirane dušične kiseline, dušikov dioksid se proizvodi izravno u reakciji sa stehiometrijom 1:4:
Cu + 4 H+ + 2 NO3- → Cu2+ + 2 NO2 + 2 H2O
U reakciji s dušičnom kiselinom većina metala daje odgovarajuće nitrate. Neki metaloidi i metali daju okside; na primjer, Sn, As, Sb i Ti se oksidiraju u SnO2, As2O5, Sb2O5 i TiO2 redom.[25]
Neki plemeniti metali, kao što su čisto zlato i metali platinske skupine, ne reagiraju s dušičnom kiselinom, iako čisto zlato reagira s aqua regia, mješavinom koncentrirane dušične kiseline i klorovodične kiseline. Međutim, neki manje plemeniti metali (Ag, Cu, ...) prisutni u nekim zlatnim legurama relativno siromašnim zlatom, kao što je obojeno zlato, mogu se lako oksidirati i otopiti dušičnom kiselinom, što dovodi do promjene boje površine zlatne legure. Dušična kiselina se koristi kao jeftino sredstvo u zlatarnicama za brzo uočavanje legura s niskim sadržajem zlata (< 14 karata) i za brzu procjenu čistoće zlata.
Budući da je snažno oksidacijsko sredstvo, dušična kiselina reagira s mnogim nemetalnim spojevima, ponekad eksplozivno. Ovisno o koncentraciji kiseline, temperaturi i redukcijskom sredstvu koje je uključeno, krajnji proizvodi mogu biti promjenjivi. Reakcija se odvija sa svim metalima osim serije plemenitih metala i određenih legura. Kao opće pravilo, reakcije oksidacije odvijaju se prvenstveno s koncentriranom kiselinom, pogodujući stvaranju dušikovog dioksida (NO2). Međutim, snažna oksidacijska svojstva dušične kiseline su termodinamičke prirode, ali ponekad su njezine oksidacijske reakcije prilično kinetički nepovoljne. Prisutnost malih količina dušikaste kiseline (HNO2) uvelike povećava brzinu reakcije.[26]
Iako se krom (Cr), željezo (Fe) i aluminij (Al) lako otapaju u razrijeđenoj dušičnoj kiselini, koncentrirana kiselina stvara sloj metalnog oksida koji štiti glavninu metala od daljnje oksidacije. Stvaranje ovog zaštitnog sloja naziva se pasivizacija.[27] Uobičajene koncentracije pasivizacije kreću se od 20% do 50% po volumenu.[28] Metali koji se pasiviziraju koncentriranom dušičnom kiselinom su željezo, kobalt, krom, nikal i aluminij.[29]
Reakcija s nemetalima
urediBudući da je moćna oksidirajuća kiselina, dušična kiselina reagira s mnogim organskim materijalima, a reakcije mogu biti eksplozivne. Hidroksilna skupina će tipično odvojiti vodik od organske molekule da nastane voda, a preostala nitro skupina zauzima mjesto vodika. Nitracija organskih spojeva dušičnom kiselinom primarna je metoda sinteze mnogih uobičajenih eksploziva, poput nitroglicerina i trinitrotoluena (TNT). Budući da je moguće mnogo manje stabilnih nusproizvoda, te se reakcije moraju pažljivo termički kontrolirati, a nusprodukti ukloniti kako bi se izolirao željeni produkt.
Reakcija s nemetalnim elementima, s iznimkom dušika, kisika, plemenitih plinova, silicija i halogena osim joda, obično ih oksidira do njihovih najviših oksidacijskih stanja kao kiseline uz stvaranje dušikovog dioksida za koncentriranu kiselinu i dušikovog oksida za razrijeđenu kiselina.
C (grafit) + 4 HNO3 → CO2 + 4 NO2 + 2 H2O
3 C (grafit) + 4 HNO3 → 3 CO2 + 4 NO + 2 H2O
Koncentrirana dušična kiselina oksidira I2, P4 i S8 u HIO3, H3PO4, odnosno H2SO4.[27] Iako reagira s grafitom i amorfnim ugljikom, ne reagira s dijamantom; može odvojiti dijamant od grafita koji oksidira.[30]
Ksantoproteinska reakcija
urediDušična kiselina reagira s proteinima stvarajući žute nitrirane proizvode. Ova reakcija je poznata kao ksantoproteinska reakcija. Ovo ispitivanje provodi se dodavanjem koncentrirane dušične kiseline u tvar koja se ispituje, a zatim zagrijavanjem smjese. Ako su prisutni proteini koji sadrže aminokiseline s aromatskim prstenovima, smjesa postaje žuta. Nakon dodavanja baze kao što je amonijak, boja postaje narančasta. Ove promjene boje uzrokuju nitrirani aromatski prstenovi u proteinu.[31][32] Ksantoproteinska se reakcija događa kada kiselina dođe u kontakt sa epitelnim stanicama. Odgovarajuće lokalne promjene boje kože ukazuju na neodgovarajuće mjere opreza pri rukovanju dušičnom kiselinom.
Proizvodnja
urediIndustrijska proizvodnja dušične kiseline koristi Ostwaldov proces. Kombinirani Ostwald i Haber procesi su izuzetno učinkoviti, zahtijevajući samo zrak i prirodni plin kao sirovinu.[33]
Tehnička inovacija Ostwaldovog procesa su ispravni uvjeti pod kojima bezvodni amonijak izgara u dušikov oksid (NO) umjesto dušika (N2).[33][34]Dušikov oksid se zatim oksidira, često s atmosferskim kisikom, u dušikov dioksid (NO2):
2 NO + O2 → 2 NO2
Dioksid zatim disproporcionira u vodi do dušične kiseline i sirovine dušikovog oksida:
3 NO2 + H2O → 2 HNO3 + NO
Ukupna reakcija je maksimalna oksidacija amonijaka:
NH3 + 2 O2 → HNO3 + H2O
Otopljeni dušikovi oksidi se ili uklanjaju (u slučaju bijele dimeće dušične kiseline) ili ostaju u otopini stvarajući crvenu dimeću dušičnu kiselinu.
Komercijalne otopine dušične kiseline obično imaju između 52% i 68% dušične kiseline po masi, što je najveća koncentracija koja se može destilirati. Daljnja dehidracija do 98% može se postići koncentriranom H2SO4.[33][35] Povijesno gledano, veće koncentracije kiseline također su se proizvodile otapanjem dodatnog dušikovog dioksida u kiselini, ali posljednje postrojenje u Sjedinjenim Državama prestalo je koristiti taj proces 2012. godine.[35]
Nedavno su razvijena elektrokemijska sredstva za proizvodnju bezvodne kiseline iz koncentrirane sirovine dušične kiseline.[36]
Laboratorijska sinteza
urediLaboratorijske sinteze dušične kiseline obiluju. Većina se inspirira industrijskim tehnikama.
Veliki izbor nitratnih soli metatezira sa sumpornom kiselinom (H2SO4) — na primjer, natrijev nitrat:
NaNO3 + H2SO4 → HNO3 + NaHSO4
Destilacijom na vrelištu dušične kiseline od 83 °C zatim se odvaja kruti ostatak metalne soli.[26] Rezultirajuća kisela otopina je 68,5% azeotropa i može se dalje koncentrirati (kao u industriji) bilo sumpornom kiselinom ili magnezijevim nitratom.[36]
Alternativno, toplinska razgradnja bakrovog(II) nitrata daje dušikov dioksid i plinove kisika; zatim prolaze kroz vodu ili vodikov peroksid[37] kao u Ostwaldovom procesu:
2 Cu(NO3)2 → 2 CuO + 4 NO2 + O2
2 NO2 + H2O → HNO2 + HNO3 ili 2 NO2 + H2O2 → 2 HNO3
Uporaba
urediGlavna industrijska upotreba dušične kiseline je za proizvodnju gnojiva. Dušična kiselina se neutralizira amonijakom da bi se dobio amonijev nitrat. Ova primjena troši 75-80% od 26 milijuna tona proizvedenih godišnje (1987.). Ostale glavne primjene su za proizvodnju eksploziva, prekursora najlona i posebnih organskih spojeva.[38]
Prekursor do nitriranih organskih spojeva
urediU organskoj sintezi, industrijskoj i drugoj, nitro skupina je svestrana funkcionalna skupina. Mješavina dušične i sumporne kiseline uvodi nitro supstituent na razne aromatske spojeve elektrofilnom aromatskom supstitucijom. Mnogi eksplozivi, poput TNT-a, pripremaju se na ovaj način:
C6H5CH3 + 3 HNO3 → C6H2(NO2)3CH3 + 3 H2O
Koncentrirana sumporna kiselina ili oleum apsorbiraju višak vode.
H2S2O7 + H2O → 2 H2SO4
Nitro skupina se može reducirati kako bi se dobila aminska skupina, što omogućuje sintezu anilinskih spojeva iz različitih nitrobenzena:
Oksidans
urediPrethodnik najlona, adipinska kiselina, proizvodi se u velikoj mjeri oksidacijom "KA ulja" — mješavine cikloheksanona i cikloheksanola — s dušičnom kiselinom.[38]
Raketno pogonsko gorivo
urediDušična kiselina korištena je u različitim oblicima kao oksidans u raketama na tekuće gorivo. Ti oblici uključuju crvenu dimeću dušičnu kiselinu, bijelu dimeću dušičnu kiselinu, smjese sa sumpornom kiselinom i ove oblike s inhibitorom HF.[39] IRFNA (inhibited red fuming nitric acid) bila je jedna od tri komponente tekućeg goriva za projektil BOMARC.[40]
Druge koristi
urediObrada metala
urediDušična kiselina može se koristiti za pretvaranje metala u oksidirane oblike, kao što je pretvaranje metalnog bakra u bakrov(II) nitrat. Također se može koristiti u kombinaciji s klorovodičnom kiselinom kao aqua regia za otapanje plemenitih metala poput zlata. Ove se soli mogu koristiti za pročišćavanje zlata i drugih metala iznad 99,9% čistoće procesima rekristalizacije i selektivnog taloženja. Njegova sposobnost da selektivno otapa određene metale ili da bude otapalo za mnoge metalne soli čini ga korisnim u postupcima odvajanja zlata.
Analitički reagens
urediU elementarnoj analizi pomoću ICP-MS, ICP-AES, GFAA i Flame AA, razrijeđena dušična kiselina (0,5-5,0%) koristi se kao matrični spoj za određivanje tragova metala u otopinama.[41] Za takvo određivanje potrebna je ultračista kiselina u tragovima metala, jer male količine metalnih iona mogu utjecati na rezultat analize.
Također se obično koristi u procesu digestije uzoraka mutne vode, uzoraka mulja, krutih uzoraka kao i drugih vrsta jedinstvenih uzoraka koji zahtijevaju elementarnu analizu putem ICP-MS, ICP-OES, ICP-AES, GFAA i plamene atomske apsorpcijske spektroskopije. Obično se za ove digestije koristi 50% otopina kupljenog HNO3 pomiješana s vodom tipa 1 DI.
U elektrokemiji, dušična kiselina se koristi kao kemijsko sredstvo za dopiranje organskih poluvodiča i u procesima pročišćavanja sirovih ugljikovih nanocijevi.
Obrada drva
urediU niskoj koncentraciji (otprilike 10%) dušična kiselina često se koristi za umjetno starenje bora i javora. Proizvedena boja je sivo-zlatna, vrlo slična vrlo starom drvu obrađenom voskom ili uljem (završna obrada drva).[42]
Sredstvo za jetkanje i čišćenje
urediKorozivni učinci dušične kiseline iskorištavaju se za neke specijalne primjene, kao što je jetkanje u tiskarstvu, dekapiranje nehrđajućeg čelika ili čišćenje silicijskih pločica u elektronici.[43]
Otopina dušične kiseline, vode i alkohola, nital, koristi se za jetkanje metala kako bi se otkrila mikrostruktura. ISO 14104 jedna je od normi koja detaljno opisuje ovaj dobro poznati postupak.[44]
Dušična kiselina se koristi ili u kombinaciji s klorovodičnom kiselinom ili sama za čišćenje staklenih pokrovnih stakalca i stakalca za vrhunske mikroskopske primjene.[45] Također se koristi za čišćenje stakla prije posrebrenja pri izradi srebrnih ogledala.[46]
Komercijalno dostupne vodene mješavine od 5–30 % dušične kiseline i 15–40 % fosforne kiseline obično se koriste za čišćenje hrane i opreme za mliječne proizvode prvenstveno za uklanjanje istaloženih kalcijevih i magnezijevih spojeva (bilo taloženih iz procesnog toka ili rezultat uporabe tvrde vode tijekom proizvodnje i čišćenja). Sadržaj fosforne kiseline pomaže u pasivizaciji željeznih legura protiv korozije razrijeđenom dušičnom kiselinom.
Dušična kiselina se može koristiti kao spot test za alkaloide poput LSD-a, dajući različite boje ovisno o alkaloidu.[47]
Prerada nuklearnog goriva
urediDušična kiselina igra ključnu ulogu u PUREX-u i drugim metodama prerade nuklearnog goriva, gdje može otopiti mnogo različitih aktinoida. Nastali nitrati pretvaraju se u različite komplekse koji mogu reagirati i selektivno ekstrahirati kako bi se metali odvojili jedan od drugog.
Sigurnost
urediDušična kiselina je korozivna kiselina i snažno oksidacijsko sredstvo. Najveća opasnost od njega su kemijske opekline, jer vrši kiselu hidrolizu s proteinima (amid) i masti (ester), što posljedično razgrađuje živo tkivo (npr. kožu i meso). Koncentrirana dušična kiselina boji ljudsku kožu u žuto zbog svoje reakcije s keratinom. Ove žute mrlje postaju narančaste kada se neutraliziraju.[48] Sistemski učinci nisu vjerojatni, a tvar se ne smatra kancerogenom ili mutagenom.[49]
Standardni tretman prve pomoći za izlijevanje kiseline na kožu je, kao i za druge korozivne agense, ispiranje velikom količinom vode. Ispiranje se nastavlja najmanje 10-15 minuta kako bi se ohladilo tkivo koje okružuje opeklinu kiselinom i spriječilo sekundarno oštećenje. Kontaminirana odjeća se odmah uklanja, a koža ispod se temeljito opere.
Budući da je jako oksidacijsko sredstvo, dušična kiselina može burno reagirati s mnogim spojevima.
Izvori
uredi- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 465–471. ISBN 978-0-08-037941-8.
- ↑ Multhauf, Robert P. (1966). The Origins of Chemistry.
- ↑ Karpenko, Vladimír; Norris, John A. (2002). "Vitriol in the History of Chemistry"
- ↑ For the claims regarding the Ṣundūq al-ḥikma, see Al-Hassan 2001, p. 62; p. 60. For the claim regarding the Taʿwīdh al-Ḥākim, see Al-Hassan 2001, p. 62.
- ↑ Discovery: A Monthly Popular Journal of Knowledge. John Murray. 1924.
- ↑ a b Ḥasan, Aḥmad Yūsuf; Hill, Donald Routledge (1986). Islamic Technology: An Illustrated History. Cambridge University Press. p. 147. ISBN 978-92-3-102294-4.
- ↑ a b Chisholm, Hugh, ed. (1911). "Nitric Acid" . Encyclopædia Britannica. Vol. 19 (11th ed.). Cambridge University Press. pp. 711–712.
- ↑ Thomson, Thomas (1830). The history of chemistry. Vol. 1. Cushing/Whitney Medical Library, Yale University. London, H. Colburn, and R. Bentley. p. 40.
- ↑ Katz, David A. (2008). An Illustrated History of Alchemy and Early Chemistry (PDF). p. 23. Retrieved 21 October 2023.
- ↑ Gillispie, Charles Coulston (1960). The Edge of Objectivity: An Essay in the History of Scientific Ideas. Princeton, NJ: Princeton University Press. pp. 223–24. ISBN 0-691-02350-6.
- ↑ Davy, John, ed. (1839). "On Some Chemical Agencies of Electricity". The Collected Works of Sir Humphry Davy. Vol. 5. pp. 1–12.
- ↑ Mellor, J. W. (1918). Modern Inorganic Chemistry. Longmans, Green and Co. p. 509.
- ↑ Mellor, J. W. (1918). Modern Inorganic Chemistry. Longmans, Green and Co. p. 509.
- ↑ Martin, Geoffrey; Barbour, William (1915). Industrial Nitrogen Compounds and Explosives. Crosby Lockwood and Son. p. 21.
- ↑ Knox, Joseph (1914). The Fixation of Atmospheric Nitrogen. D. Van Nostrand Company. pp. 45–50.
- ↑ a b Dary, G. (1913). "The Production of Nitrates by the Direct Electrolysis of Peat Deposits". London Electrical Review. 73: 1020–1021.
- ↑ Hale, Arthur (1919). The Manufacture of Chemicals by Electrolysis. D. Van Nostrand Co. pp. 30–32. Retrieved 2019-09-15.
- ↑ Dean, John (1992). Lange's Handbook of Chemistry (14 ed.). McGraw-Hill. pp. 2.79–2.80. ISBN 978-0-07-016194-8.
- ↑ Wolfram Research, Inc., Wolfram|Alpha Knowledgebase, Champaign, IL (2022) — via Wolfram|Alpha.
- ↑ a b Cox, A. P.; Ellis, M. C.; Attfield, C. J.; Ferris, A. C. (1994). "Microwave spectrum of DNO3, and average structures of nitric and nitrous acids". J. Mol. Struct. 320 (1–2): 91–106. Bibcode:1994JMoSt.320...91C. doi:10.1016/0022-2860(93)08008-R.
- ↑ Luzzati, V. (1951). "Structure cristalline de l'acide nitrique anhydre". Acta Crystallographica (in French). 4 (2): 120–131.
- ↑ Allan, D. R.; Marshall, W. G.; Francis, D. J.; Oswald, I. D. H.; Pulham, C. R.; Spanswick, C. (2010). "The crystal structures of the low-temperature and high-pressure polymorphs of nitric acid" (PDF). Dalton Trans. (Submitted manuscript). 39 (15): 3736–3743. doi:10.1039/B923975H. PMID 20354626.
- ↑ Cox, A. P.; Riveros, J. M. (1965). "Microwave Spectrum and Structure of Nitric Acid". The Journal of Chemical Physics. 42 (9): 3106. Bibcode:1965JChPh..42.3106C. doi:10.1063/1.1696387.
- ↑ IUPAC SC-Database A comprehensive database of published data on equilibrium constants of metal complexes and ligands
- ↑ Catherine E. Housecroft; Alan G. Sharpe (2008). "Chapter 15: The group 15 elements". Inorganic Chemistry (3rd ed.). Pearson. ISBN 978-0-13-175553-6.
- ↑ Catherine E. Housecroft; Alan G. Sharpe (2008). "Chapter 15: The group 15 elements". Inorganic Chemistry (3rd ed.). Pearson. ISBN 978-0-13-175553-6.
- ↑ a b Catherine E. Housecroft; Alan G. Sharpe (2008). "Chapter 15: The group 15 elements". Inorganic Chemistry (3rd ed.). Pearson. ISBN 978-0-13-175553-6.
- ↑ ASTM standard A967-05
- ↑ Catherine E. Housecroft; Alan G. Sharpe (2008). "Chapter 15: The group 15 elements". Inorganic Chemistry (3rd ed.). Pearson. ISBN 978-0-13-175553-6.
- ↑ Ōsawa, Eiji (December 2007). "Recent progress and perspectives in single-digit nanodiamond". Diamond and Related Materials. 16 (12): 2018–2022. Bibcode:2007DRM....16.2018O. doi:10.1016/j.diamond.2007.08.008.
- ↑ Sherman, Henry Clapp (2007). Methods of organic analysis. Read Books. p. 315. ISBN 978-1-4086-2802-7.
- ↑ Knowles, Frank (2007). A practical course in agricultural chemistry. Read Books. p. 76. ISBN 978-1-4067-4583-2.
- ↑ a b c Considine, Douglas M., ed. (1974). Chemical and process technology encyclopedia. New York: McGraw-Hill. pp. 769–72. ISBN 978-0-07-012423-3.
- ↑ Foist, Laura. "The Ostwald Process & Catalytic Oxidation of Ammonia". Study.com. Retrieved 5 January 2019.
- ↑ a b Wiley (2020). "Nitric acid". Kirk-Othmer Encyclopedia of Chemical Technology. pp. 1–37. doi:10.1002/0471238961.1409201803120118.a01.pub3. ISBN 9780471484943. S2CID 260923593. Retrieved 2023-08-09.
- ↑ US 6200456, Harrar, Jackson E.; Quong, Roland & Rigdon, Lester P. et al., "Large-scale production of anhydrous nitric acid and nitric acid solutions of dinitrogen pentoxide", published April 13, 1987, issued March 13, 2001, assigned to United States Department of Energy
- ↑ Dong, Kai (April 19, 2024). "H2O2-mediated electrosynthesis of nitrate from air". Nature.
- ↑ a b Thiemann, Michael; Scheibler, Erich; Wiegand, Karl Wilhelm (2000). "Nitric Acid, Nitrous Acid, and Nitrogen Oxides". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a17_293. ISBN 978-3527306732.
- ↑ Clark, John D (1972). Ignition!. Rutgers University Press. ISBN 978-0-8135-0725-5.
- ↑ "BOMARC Summary". BILLONY.COM. Retrieved 2009-05-28.
- ↑ Eaton, Andrew D.; Greenberg, Arnold E.; Rice, Eugene W.; Clesceri, Lenore S.; Franson, Mary Ann H., eds. (2005). Standard Methods For the Examination of Water and Wastewater (21 ed.). American Public Health Association. ISBN 978-0-87553-047-5. Also available on CD-ROM and online by subscription
- ↑ Jewitt, Jeff (1997). Hand-applied finishes. Taunton Press. ISBN 978-1-56158-154-2. Retrieved 2009-05-28.
- ↑ Muraoka, Hisashi (1995) "Silicon wafer cleaning fluid with HNO3, HF, HCl, surfactant, and water" U.S. patent 5,635,463
- ↑ ISO 14104:2017 - Gears - Surface temper etch inspection after grinding, chemical method.
- ↑ Fischer, A. H.; Jacobson, K. A.; Rose, J.; Zeller, R. (1 May 2008). "Preparation of Slides and Coverslips for Microscopy". Cold Spring Harbor Protocols. 2008 (6): pdb.prot4988. doi:10.1101/pdb.prot4988. PMID 21356831.
- ↑ Curtis, Heber D. (February 1911). "Methods of Silvering Mirrors". Publications of the Astronomical Society of the Pacific. 23 (135): 13. Bibcode:1911PASP...23...13C. doi:10.1086/122040. hdl:2027/mdp.39015018047608. S2CID 120665136.
- ↑ O’Neal, Carol L; Crouch, Dennis J; Fatah, Alim A (April 2000). "Validation of twelve chemical spot tests for the detection of drugs of abuse". Forensic Science International. 109 (3): 189–201. doi:10.1016/S0379-0738(99)00235-2. PMID 10725655.
- ↑ May, Paul (November 2007). "Nitric acid". Retrieved 2009-05-28.
- ↑ "Nitric acid: Toxicological overview". Health Protection Agency. Retrieved 2011-12-07.



