Elektrolitska disocijacija
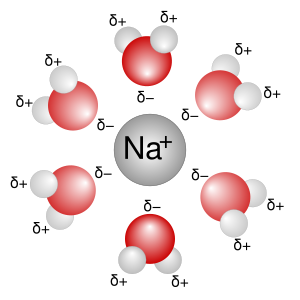
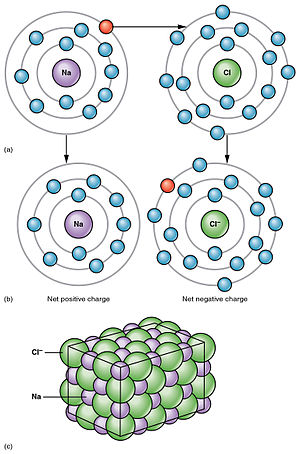
Elektrolitska disocijacija je rastavljanje elektrolita na ione otapanjem ili taljenjem, što je uzrok električnoj vodljivosti njihovih otopina ili talina. Disocijacija takozvanih pravih elektrolita ili ionofora (grč. nosioci iona), koji se i prije disocijacije sastoje od iona (ionski kristali), događa se samo otapanjem, a na rastavljenim se ionima nakupljaju molekule otapala (solvatacija). Ako se takva kristalna rešetka razori grijanjem, to jest ako se pravi elektrolit rastali, dobije se tekućina koja se sastoji samo od iona, te je stoga električki vodljiva. Tako na primjer kristal natrijeva klorida NaCl (kuhinjska sol) tvore ioni natrija Na+ i klora Cl–, no čvrsti kristal NaCl ne provodi električnu struju jer se ioni ne mogu kretati kroz kristal. Djelovanjem vode kristal se otapa, ioni natrija i klora razdvajaju se i hidratiziraju (okružuju se molekulama vode), a nastala vodena otopina može voditi električnu struju. Međutim, disocijacija takozvanih potencijalnih elektrolita ili ionogena (grč. proizvoditelji iona), koji se prije disocijacije ne sastoje od iona, događa se tek kemijskom reakcijom njihovih molekula s molekulama otapala. Potencijalni elektroliti jesu kemijski spojevi koji se i u čvrstom i u tekućem (rastaljenom) stanju sastoje od neutralnih molekula sastavljenih od atoma među sobom vezanih u biti neionskim vezama, te stoga, kad su čisti, ni rastaljeni ne vode električnu struju, ali otopljeni u pogodnom otapalu reagiraju s njime uz postanak električki nabijenih čestica, iona. Tako na primjer plin klorovodik HCl u kemijskoj reakciji s vodom daje hidronijev ion H3O+ i ion klora Cl–.[1]

Povijest
urediElektrolitsku disocijaciju otapanjem u vodi prvi je 1887. objasnio S. A. Arrhenius. Arrheniusova teorija elektrolitske disocijacije protumačila je važne kemijske pojave (reakcije elektrolita, njihovu električnu vodljivost, odstupanje njihova osmotskog tlaka i tako dalje).
Disocijacija
urediDisocijacija (lat. dissociatio: razdvajanje), u kemiji i biokemiji, je raspadanje ili rastavljanje (razdvajanje) molekula na jednostavnije sastojke, manje dijelove (manje molekule, atome, ione, radikale, komplekse, soli). Raspadanje djelovanjem topline naziva se termička disocijacija, djelovanjem svjetlosti fotokemijska disocijacija, a rastavljanje molekula ili ionskih kristala na ione u otopinama ili u talinama soli naziva se elektrolitska disocijacija.[2] To je proces suprotan procesu asocijacije.
Objašnjenje
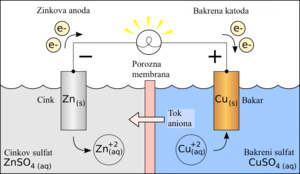
urediAko imamo posudu s destiliranom vodom i u nju se postave dvije platinske pločice spojene s izvorom struje, električna žarulja koja se nalazi u strujnom krugu će svijetliti ako se pločice od platine dodiruju, a ugasit će se čim se pločice rastave. To znači da je destilirana voda električni izolator jer ne provodi električnu struju. Međutim ako ulijemo u destiliranu vodu malo sumporne kiseline, žarulja će odmah zasvijetliti iako su pločice rastavljene. Voda je sada postala električni vodič i na platinskim su se pločicama pojavili mjehurići plina. Ploča koja je spojena s plus polom izvora struje zove se anoda, a ona koja je spojena s minus polom naziva se katoda. Anoda i katoda su zajedničkim imenom elektrode. Mjesto sumporne kiseline mogli smo u vodu staviti i neke druge tvari, na primjer natrijevu sol, dušičnu kiselinu i druge, pa bismo vidjeli da otopine tih tvari provode električnu struju.
Električnu struju u metalima stvara gibanje slobodnih elektrona, pa se metali zovu i električni vodiči prvog reda. Vodene otopine kiselina, baza i soli koje provode električnu struju zovu se električni vodiči drugog reda ili elektroliti.
Prolaz električne struje kroz tekućine protumačio je švedski kemičar S. A. Arrhenius svojom hipotezom o električnoj disocijaciji. Prema toj hipotezi raspadaju se molekule elektrolita već kod otapanja u vodi u električki nabijene čestice koje se slobodno gibaju. Ti djelići materije koji nose električne naboje zovu se ioni. Ovo raspadanje molekula na ione prilikom otapanja zove se elektrolitička disocijacija. U svakom je elektrolitu jedan dio otopljene tvari disociran, a drugi nije. Nedisocirani dio sadrži u otopini cijele molekule koje nemaju nikakvog električnog naboja i zovu se neutralne molekule. Disocirani dio sadrži električki nabijene čestice, to jest ione.
Ione privlače protivno nabijene elektrode, oni putuju do elektroda i tamo predaju svoj električni naboj. Ioni koji putuju na katodu nabijeni su pozitivno i zovu se kationi, a ioni koji putuju na anodu nabijeni su negativno i zovu se anioni. Katione označujemo oznakom +, a anione oznakom -. Tako na primjer u otopini kuhinjske soli NaCl ima oznake Na+ i Cl-. Na elektrodama se naboj iona izjednači s protivnim nabojem elektrode ili točnije iz kovne elektrode izađe slobodni elektron i spoji se s pozitivnim kationom u neutralni atom. Negativni se anion nautralizira tako da s njega prijeđe jedan elektron na kovnu anodu.[3]
Stupanj disocijacije
urediStupanj disocijacije molekula ovisi o naravi elektrolita, koncentraciji i temperaturi, a određuje se mjerenjem električne vodljivosti otopine. On je to viši što je otopina elektrolita razrjeđenija. Visok stupanj disocijacije pokazuju jake kiseline, jake baze i soli jakih kiselina i jakih baza. U vrlo razrijeđenim vodenim otopinama disocirane su gotovo sve jedinke tih elektrolita. Sama voda slab je elektrolit i neznatno je disocirana, pa jedna litra sadržava tek po 10-7 mola iona H+ i OH-. Umnožak tih dviju koncentracija stalan je u svim vodenim otopinama (pH ili pH-vrijednost).
Konstanta disocijacije
urediZa reverzibilnu disocijaciju:
konstanta disocijacije Kd pokazuje omjer disocirane i nedisocirane sastavine:
Izvori
uredi- ↑ elektrolitska disocijacija, [1] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2017.
- ↑ disocijacija, [2] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2017.
- ↑ Velimir Kruz: "Tehnička fizika za tehničke škole", "Školska knjiga" Zagreb, 1969.