Boudouardova ravnoteža
Boudouardova ravnoteža ili Boudouardova reakcija je kemijska ravnoteža koja se uspostavlja kod reakcije ugljikova(IV) oksida (ugljikov dioksid) s ugljikom u visokoj peći. Zbog endotermnosti reakcije povećanje temperature pomiče reakciju udesno, a sniženje temperature ulijevo:[1]
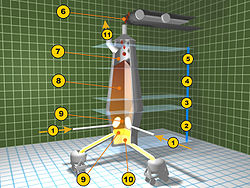
1. puhalice zraka koji dolazi iz zagrijača zraka (kauperi)
2. područje topljenja metala
3. područje željezovih(III) oksida
4. područje željezovih(II) oksida
5. područje predgrijavanja (ždrijelo)
6. zasipni uređaji (željezna ruda, koks i vapnenac)
7. grotleni plinovi
8. slojevi željezne rude, koksa i vapnenca
9. ispust troske
10. ispust sirovog željeza
11. izlaz grotlenih plinova.
- 2CO CO2 + C
Reakcija u smjeru s lijeva na desno se naziva Bellova reakcija (prema I. L. Bellu), dok s desna na lijevo se naziva Boudouardova reakcija (prema Octave Leopold Boudouardu (1872. — 1923.)). Što je veća temperatura to više prevladava Boudouardova reakcija. Tako na primjer na temperaturi od 825 ºC, prevladava Boudouardova reakcija s otprilike 90%.
Boudouardova reakcija se u visokoj peći odvija u zoni redukcije, koja se nalazi iznad zone oksidacije. U zoni oksidacije gorivo potpuno sagorijeva s kisikom iz zraka, čime se oslobađa toplina sagorijevanja i postiže temperatura oko 1200 °C. Osnovna reakcija oksidacije prikazuje se jednadžbom:
- C + O2 = CO2
Kemijska ravnoteža je stupanj reverzibilne reakcije u zatvorenom sustavu kad se napredna i povratna reakcija događaju istom brzinom, a njihovi se učinci međusobno poništavaju, dok se koncentracije reaktanata i produkata ne mijenjaju.[2]
Izvori
uredi- ↑ "Tehnička enciklopedija", glavni urednik Hrvoje Požar, Grafički zavod Hrvatske, 1987.
- ↑ [1] Arhivirana inačica izvorne stranice od 4. srpnja 2014. (Wayback Machine) "Fizikalna metalurgija I", dr.sc. Tanja Matković, dr.sc. Prosper Matković, www.simet.unizg.hr, 2011.
